蓄電池の仕組みと働き
蓄電池とは、充電を行うことによって電気を貯め、繰り返し使用することが出来る電池のことを指します。
従来より自動車や航空機・農業機械など各種車両を始め、小型電子機器やモバイル端末、施設の非常用電源などで利用されており、蓄電池は私達の生活の上でなくてはならないものとなっています。
日本においては、1895年に島津製作所が初めて鉛蓄電池の製造に成功して以来、常に世界における蓄電池シェアのトップをキープしており、現在では単なる蓄電池としてではなく、系統安定化対策やハイブリッド車・電気自動車への実装などでも大きな注目を集めています。
ここでは、現在実際に普及が進んでいる鉛蓄電池、ニッケル水素電池、リチウムイオン電池、NAS電池の4種類に焦点を当て、その仕組みについて解説していきます。
蓄電池の働き
例として、家庭用蓄電池を導入した場合にはどのように利用できるのでしょうか。
下図は、家庭用蓄電システムのシステム構成を表したもの。
電力線は停電時に給電されない一般負荷電源ライン(青線)と、停電時に電力が送られる重要負荷電源ライン(緑線)に分かれており、別々の分電盤を使用します。
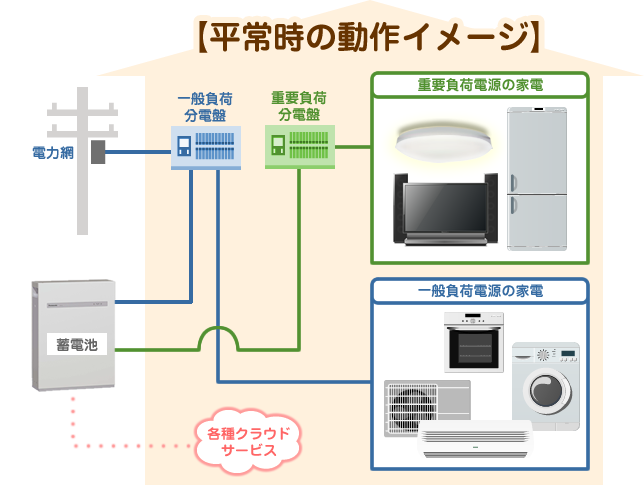
平常時においては、電力系統と接続された一般負荷電源ラインを介し、蓄電池の運転モードに合わせて電力を供給したり蓄電を行うことができます。
非常時においては、一般負荷電源ラインが使用出来なくなるため、放電することで重要負荷(特定負荷)に電力を供給することが可能となります。
電池の充電状況や異常は通信ライン(赤点線)を経由して接続されている操作パネルや見える化システムを用いて、確認できるようになっています。
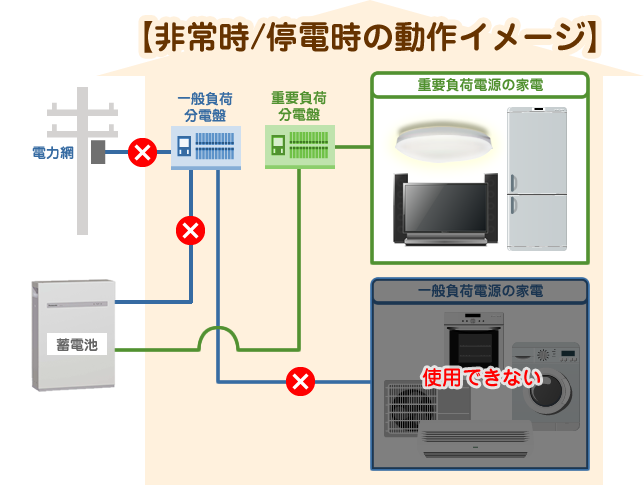
停電時の系統への影響や作業員の感電を防止するためにも、重要負荷電源ラインは系統に接続されていません。
その代わり、停電時でも自動的に蓄電システムからの給電に切り替わるようになっている仕組みが組み込まれている製品がほとんどでしょう。
充放電の原理
電池は、イオン化傾向の異なる2種類(+極と-極)の金属と電解液から構成されており、化学反応を用いて発生した電気を取り出しています。
この2種類の金属のうち、負極にはイオン化傾向の大きい(電解液に溶けやすい)金属が、正極にはイオン化傾向の小さい(電解液に溶けにくい)金属が用いられており、負極の金属がイオン化することで電子を放出し、正極へと流れていくことで、電気が発生するという仕組みになっているのです。(放電)
なお、イオン化傾向の大小は金属によって異なり、正極の金属と負極の金属のイオン化傾向の差が大きければ大きいほどより高い起電力(電圧)を得ることが可能です。
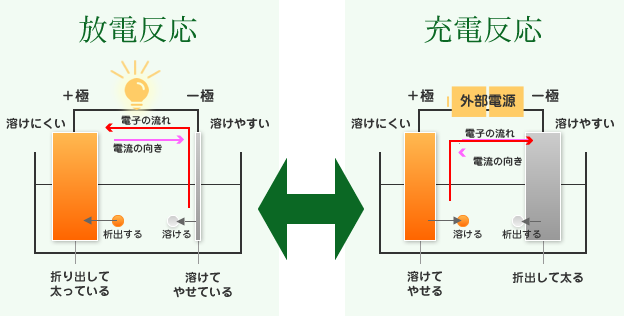
しかし、このまま放電していくと、イオン化傾向の大きい負極は溶けてしまい、最終的には反応出来なくなるため、乾電池(一次電池)の場合はここで電池を交換する以外ありませんが、二次電池では充電を行うことで再び使用することが出来ます。
充電は放電の逆反応となり、エネルギーをかけて逆向きに電流を流します。
これにより、正極の金属が溶け出してイオンとなり、負極でイオンが金属となって析出することで、放電前の状態に戻るということです。
種類別蓄電池の仕組み
種類別蓄電池「鉛蓄電池」

鉛蓄電池は、1859年にフランスの科学者ガストン・プランテによって開発され、二次電池の中で最も古い歴史を持っており、主に自動車のバッテリーとして広く利用されている他、非常用電源や電動車用主電源などにも用いられています。
鉛蓄電池では、正極に二酸化鉛(PbO2)、負極に鉛(Pb)、電解液に希硫酸(H2SO2)を用いており、放電すると正極・負極ともに同じ物質(PbSO4)を発生させます。
充電が完了すると両電極の硫酸鉛はほとんどが分解されて元の活物質に戻りますが、充放電が繰り返されると負極の金属に硫酸鉛の硬い結晶が発生しやすくなります。(サルフェーション)
そのため、使用回数の上昇に伴って性能が劣化し、電池寿命が大幅に低下する特徴があり、放電しきる前に充電するなどの適切な利用方法が求められますが、鉛蓄電池は安価で使用実績が多く信頼性も高いため、今後も変わらず自動車のバッテリーや非常用電源として用いられてれいくことが予測されています。
種類別蓄電池「ニッケル水素電池」

1990年の実用化以降、それまでの代表的な小型二次電池であったニカド電池の2.5倍の容量を持つこと、環境への影響が少ないことなどの理由から、リチウムイオン電池の登場までモバイル機器のバッテリーを始め多く利用されていました。
その安全性の高さから、近年では主に乾電池型二次電池(エネループ等)やハイブリッドカーの動力源として用いられています。
ニッケル水素電池では、正極にオキシ水酸化ニッケル(NiOOH)、負極に水素吸蔵合金、電解液にカリウムのアルカリ水溶液を用いています。
反応の特徴として、負極で水素吸蔵合金から水素が解離し水となりますが、正極で消費されるので増減しないということが挙げられます。
ニッケル水素電池では、正極にオキシ水酸化ニッケル(NiOOH)、負極に水素吸蔵合金、電解液にカリウムのアルカリ水溶液を用いています。
反応の特徴として、負極で水素吸蔵合金から水素が解離し水となりますが、正極で消費されるので増減しないということが挙げられます。
種類別蓄電池「リチウムイオン電池」

ニッケル水素電池に変わる高容量で小型軽量な二次電池として、1991年より実用化が開始したリチウムイオン電池。
非水系の電解液を使用するため、水の電気分解電圧を超える高い電圧が得られ、エネルギー密度が高いという特徴があります。
リチウムイオン電池では、正極にリチウム含有金属酸化物、負極にグラファイトなどの炭素材、電解液に有機電解液が用いられており、グラファイト層間のリチウムイオンがLiCoO2の層間に戻ることで、電気が発生するという仕組みになっています。
ニッケル水素電池の3倍となる3.7Vもの電圧を誇り、自己放電が少ないことから、近年ではモバイル機器のバッテリーとして利用されています。
種類別蓄電池「NAS電池」

世界で唯一日本ガイシのみが製造しているナトリウム硫黄電池で、主に大規模な電力貯蔵施設や工場施設などにおいて用いられています。
NAS電池では、正極に硫黄、負極にナトリウム、電解質にβ-アルミナが用いられており、形状は円筒形で、セラミックスの中にナトリウムがあり、セラミックスを挟んで硫黄があるという構造になっています。
固体のセラミックスの中をナトリウムイオンが移動することで電気を発生する仕組みとなっていますが、そのためには充放電に伴う電池の発熱のほか、必要に応じてヒーターで加温する必要があります。
今後、再生可能エネルギーを本格的に推進していくにあたって、NAS電池やレドックスフローといった大容量向き蓄電池は重要な要素になることが予想されています。

